高考化学中的离子平衡专题是考试中的重点和难点,涉及电解质溶液中的离子反应平衡,酸碱反应,盐类水解等多个知识点,掌握离子平衡的基本原理和解题技巧,对于提高化学成绩至关重要,本文将围绕高考离子平衡专题进行解析,帮助考生深入理解并应对相关考题。
离子平衡概述
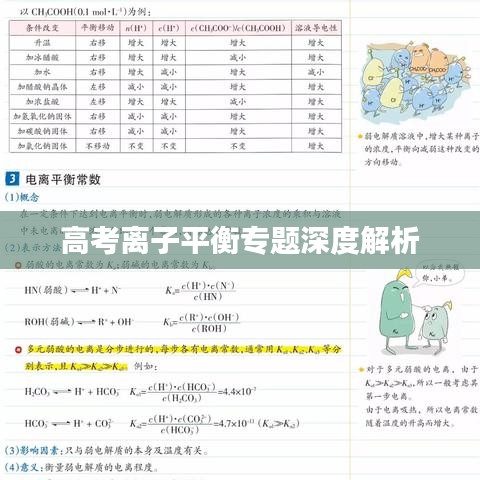
离子平衡是指电解质溶液中的离子在一定的条件下达到动态平衡的状态,电解质在溶液中会离解成离子,同时离子又会结合成分子或固体电解质,这两个过程达到动态平衡时,溶液中的离子浓度不再改变,理解离子平衡的概念是理解高考离子平衡专题的基础。
高考离子平衡专题重点
1、酸碱反应与离子平衡
酸碱反应是高考离子平衡专题中的重要内容,在酸碱反应中,H+和OH-离子的浓度变化会影响反应的进行和平衡的移动,考生需要掌握酸碱反应的实质,理解pH值的变化对离子平衡的影响。
2、盐类水解与离子平衡
盐类水解是离子平衡专题中的另一重要内容,盐类在溶液中会发生水解反应,生成相应的弱酸和弱碱,影响溶液中的离子平衡,考生需要理解盐类水解的原理和影响因索,掌握盐类水解的规律和特点。
解题技巧
1、掌握基本原理
掌握离子平衡的基本原理是解题的关键,考生需要深入理解离子平衡的概念,掌握电解质溶液中的离子反应平衡,酸碱反应和盐类水解的原理,只有掌握了这些基本原理,才能正确理解和解答相关试题。
2、分析题目信息
在解答高考离子平衡专题的试题时,考生需要仔细阅读题目,分析题目中的信息,特别是要注意题目中的关键词和条件,如溶液的颜色、pH值、离子浓度等,这些信息对于判断离子平衡的状态和移动方向非常重要。
3、运用守恒思想
在解答离子平衡相关的试题时,考生可以运用守恒思想,在电解质溶液中,电荷守恒、物料守恒、质子守恒等都可以用来判断离子平衡的状态和移动方向,运用守恒思想可以简化复杂的问题,提高解题效率。
实例解析
【例】某温度下,向1L浓度均为0.1mol·L-1的NaCl和NaHCO3混合溶液中逐滴加入稀盐酸,下列说法正确的是()
A. 加入盐酸后HCO3-水解程度减小 B. 加入盐酸至无气泡产生时发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O C. 加入盐酸至反应至中性时消耗盐酸的物质的量为0.2mol D. 加入盐酸后水的电离程度减小直至趋于零解本题的关键是掌握盐类水解的原理和影响因素以及酸碱反应对离子平衡的影响,本题通过实例解析,展示了如何运用所学知识解决实际问题的方法,考生需要深入理解离子平衡的原理和影响因素,掌握解题技巧和方法,本题答案为BD,六、总结与展望通过对高考离子平衡专题的解析,我们了解到离子平衡的基本原理和解题技巧对于提高化学成绩的重要性,考生在备考过程中应加强对离子平衡原理的理解和对解题技巧的运用,同时我们也看到随着教育改革的深入,高考离子平衡试题的难度和灵活性也在不断提高,未来高考离子平衡试题可能会更加注重对考生综合运用知识能力的考查以及对实际问题解决能力的考查,因此考生应加强对知识体系的整体把握和对实际问题解决方法的探索以适应高考的新变化。
七、备考建议:针对高考离子平衡专题的备考建议如下:首先加强基础知识的学习和理解特别是电解质溶液中的离子反应平衡酸碱反应和盐类水解的基本原理;其次加强解题技巧的训练特别是分析题目信息和运用守恒思想的技巧;最后注重实际问题的解决能力的培养通过解决实际问题来提高综合运用知识的能力,同时考生也应注意保持积极的心态和良好的学习习惯以应对高考的挑战。
转载请注明来自佛山左雅系统门窗,本文标题:《高考离子平衡专题深度解析》








 赣ICP备19014127号-1
赣ICP备19014127号-1
还没有评论,来说两句吧...